Dia 17 de outubro de 2023, duas notícias sobre o orçamento federal brasileiro circularam nas redes sociais. Uma delas anunciava o contingenciamento de R$116 milhões (US$23,3 milhões) do orçamento da Capes, agência nacional responsável pelo fomento à formação de cientistas no Brasil.[1] A outra relatava que apenas 3 medicamentos para doenças raras compunham um montante de R$ 575 milhões (US$115,6 milhões) do gasto federal.[2] Os dois orçamentos são de pastas diferentes e o gasto em um não tem relação direta com o corte em outro. Além disso, nem os cortes na ciência nem os gastos com medicamentos de alto custo são notícias novas, mas questões que frequentemente aparecem nos noticiários. No entanto, a coincidência das notícias terem circulado no mesmo dia, nos permite usá-las como anedotas para pensar nas relações entre Estado, ciência e tecnologia, indústria farmacêutica, dependência econômica e circulação global.
Os três medicamentos em questão são produzidos, comercializados e precificados por indústrias farmacêuticas com matriz nos EUA. Sob a prerrogativa do direito constitucional à saúde, o SUS, sistema público de saúde brasileiro,[3] fornece gratuitamente para a população os remédios incluídos no rol de medicamentos essenciais, incluindo aqueles de alto custo. Pessoas com condições de saúde, como câncer e doenças raras, recorrem a ações legais contra o Estado para obter acesso a tratamentos não disponíveis regularmente no sistema, o que é chamado de processo de judicialização. Dos 3 medicamentos citados na notícia, dois não estão incorporados ao SUS, o terceiro está em processo de negociação. Incorporar medicamentos no rol permitiria que o Estado pudesse negociar seus preços, aspecto importante para a sustentabilidade financeira do sistema. Essa incorporação é julgada pela Comissão Nacional de Incorporação de Tecnologias em Saúde (Conitec), após análise de custo-efetividade e de impacto orçamentário. Mas o que vem junto nessa incorporação? Ela seria o suficiente para resolver as questões econômicas e de saúde sobre a importação de drogas de alto custo?
Seguindo o medicamento
Em meu doutorado, me propus seguir um medicamento usado para tratamento da fibrose cística (FC). Trata-se da combinação de três componentes, elexacaftor/ivacaftor/tezacaftor, de nome comercial Trikafta. Eu acompanhei o processo de avaliação tecnológica em saúde (ATS) que determinaria sua incorporação no SUS. O Trikafta, assim como os medicamentos citados anteriormente, é um produto de alto custo desenvolvido e fabricado por uma indústria farmacêutica sediada nos EUA, que, até recentemente, tinha seu acesso restrito por via judicial.
Essa proposta metodológica de seguir um medicamento parte de pelo menos dois entendimentos. O primeiro é de que medicamentos são objetos materiais poderosos, com muitas implicações sociais: eles corporificam significados, participam de trocas comerciais, são altamente móveis e têm poder de transformar corpos. Assim, tornam-se commodities de alto valor econômico e político que materializam esperança para pessoas em sofrimento (Whyte, 2002). O segundo é que o processo de ATS em questão é parte de um complexo sistema global de circulação e trocas, portanto, seguir o medicamento nas relações que estabelece e nos caminhos que percorre é uma forma de melhor analisar esse objeto (Marcus, 1995).
A primeira decisão da Conitec sobre o Trikafta[4] foi pela não incorporação do medicamento, destacando que, embora a efetividade do medicamento fosse inegável, os custos envolvidos eram muito elevados, para além dos limiares de custo estabelecidos. Essa primeira decisão foi submetida à consulta pública e, após mobilização de associações de pessoas com FC, pesquisadores e profissionais da saúde e uma renegociação de preços, o medicamento foi incorporado ao SUS. A mobilização das associações e entidades científicas nos processos de participação pública, os argumentos e estratégias mobilizados, o questionamento sobre critérios e limiares de custo são aspectos centrais da minha pesquisa de doutorado corrente que eu publicarei em outros artigos no futuro.
No entanto, há um aspecto específico desse processo que eu gostaria de dialogar com interlocutores internacionais, particularmente em um blog estadunidense. Tomando o Triakfta como um objeto social complexo, que agencia múltiplas relações, o que um medicamento de alto custo traz consigo quando vem do exterior? Quais relações vem enredadas dentro da caixa do medicamento: com um sistema de saúde, com uma lógica de mercado e de propriedade intelectual, com evidências produzidas em ensaios clínicos?
O desigual mercado farmacêutico global
Entre a primeira decisão (negativa) e a segunda (positiva) da Conitec sobre o Trikafta, ocorreu o VIII Congresso Brasileiro de Fibrose Cística, no qual eu realizei observação participante. O congresso reuniu todos os principais atores envolvidos no processo da ATS: pesquisadores, profissionais da saúde, pessoas com FC, líderes de associações e gestores públicos. Nas apresentações do congresso, que foram generalizadamente orientadas a favor da incorporação do Trikafta no SUS, um mapa foi bastante compartilhado (Figura 1). Trata-se da representação da desigualdade de acesso ao medicamento no mundo.
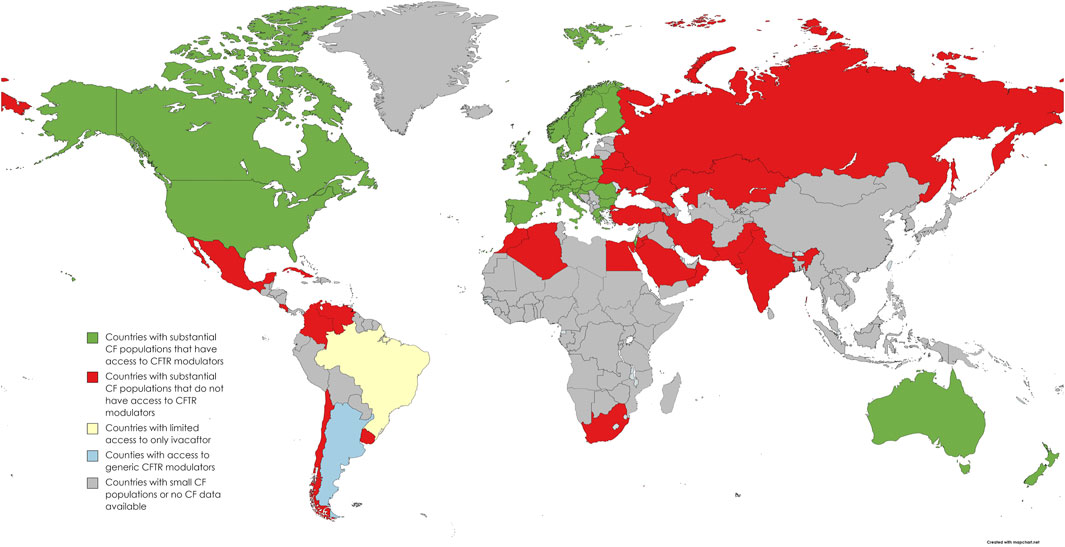
Figura 1: mapa que representa o acesso de diferentes países do mundo ao Trikafta. (Fonte de acesso aberto: Zampoli et al. 2023)
O acesso ao medicamento reproduz de modo muito fiel a divisão entre um norte global ocidental rico, e o resto do mundo. Como a mutação genética da FC que pode ser tratada pelo Trikafta é mais prevalente em países da Europa Ocidental, ou de populações majoritariamente descendente deles (como EUA, Canadá e Austrália), alguém poderia argumentar que a distribuição do medicamento apenas reflete uma distribuição genética. No entanto, países com renda média ou baixa com consideráveis populações de pessoas com FC seguiam sem acesso pleno ao Trikafta devido a seus impeditivos altos preços. Como era o caso do Brasil, país de população racialmente diversa. Além disso, como apontam Zampoli et al. (2023), como consequência dessa vinculação de raça e genética, mesmo em países ricos, as populações com FC que se declaram não brancas tem menor acesso aos tratamentos. Como então se configura esse mercado global de medicamentos?
Em seu artigo sobre o mercado de tratamentos de alto custo para câncer na Índia, Banerjee (2017) cita uma entrevista em que o CEO da farmacêutica Bayer responde às críticas sobre a dificuldade de acesso a um medicamento anti-câncer, dizendo que ele não tinha sido desenvolvido para os mercados da Índia, mas para pacientes ocidentais que podiam arcar com seu custo. Essa fala indica como junto dos medicamentos vem a pressuposição de uma população-alvo, com uma determinada renda e composição racial.
Biehl e Petryna (2016) apontam que, por outro lado, o Brasil tem se configurado como um grande alvo de mercados farmacêuticos globais. Não só por sua grande população, mas também pelas especificidades do sistema de saúde público que, amparado no direito constitucional à saúde e sujeito a processos de judicialização, tem de garantir o acesso aos medicamentos de alto custo por meio de compras estatais.[5]
No entanto, eu argumentaria que, embora a incorporação no rol de medicamentos disponibilizados pelo sistema coloque o país em uma posição melhor para negociar preços de compra, ela não resolve sozinha o problema dos altos custos seu impacto sobre o orçamento do sistema de saúde.
A política de preços e a pesquisa
No mesmo congresso citado anteriormente, uma pesquisadora da farmacêutica produtora do Trikafta apresentou novos medicamentos que estavam sendo desenvolvidos para a FC pela empresa. Ao final de sua fala, ela foi questionada por um congressista sobre os preços que seriam cobrados por esses novos produtos. Ela se esquivou da resposta, dizendo que não estava envolvida na precificação.
A pesquisadora operou uma separação entre a dimensão da pesquisa e a dimensão do mercado. Em um sentido oposto, no entanto, quando confrontadas sobre os valores de seus medicamentos de alto custo, as indústrias farmacêuticas justificam dizendo que o preço é importante para cobrir os custos com as pesquisas necessárias para viabilizar o desenvolvimento de novos medicamentos. Diminuir os preços seria uma forma de coibir a inovação (Banerjee, 2017; Zampoli et al. 2023).
Além disso, o próprio desenvolvimento de novas moléculas é compassado pelos acordos internacionais de propriedade intelectual, que expiram após 20 anos de registro. O desenvolvimento de novas composições, combinações e processos é técnico, mas também mercadológico (ibid.). Esses casos denotam como a própria pesquisa e desenvolvimento de um medicamento estão intimamente vinculados a sua circulação e venda. Mas o quanto seria uma cobrança justa e que não impediria o desenvolvimento mercadológico de novos medicamentos? Quem deve definir esse preço?
Um estudo publicado estima que o custo de produção do Trikafta é mais de 90% menor que o valor listado nos EUA (Guo et al., 2022). As negociações de preço de compra são feitas abertamente com o Estado brasileiro, diferente de outros países com sistemas públicos de saúde. Isso foi apontado por um dos meus interlocutores no congresso como um aspecto que poderia constranger a empresa a não diminuir o preço para um valor dentro do limiar estabelecido aqui no Brasil, já que isso poderia gerar uma pressão pela diminuição do preço em outros lugares do mundo.
Ao fim da negociação, o Trikafta teve sua incorporação ao SUS aprovada após uma redução de mais de 44% sobre o impacto orçamentário previsto, que diminui de 1,99 bi a 1,11 bi em 5 anos. Um valor ainda assim bastante elevado que excedia os parâmetros estabelecidos para limiar de custo efetividade.
Nesse processo, o medicamento não é somente um composto químico, mas é produto e produz uma rede de relações: com ensaios clínicos e resultados de pesquisa, com os sujeitos de pesquisa e suas esperanças e ativismos, com uma indústria produtora e suas lógicas privadas de saúde, com acordos internacionais de propriedade intelectual e registros de patente, com um mercado global de medicamentos. Tudo isso vem junto importado com a caixa do medicamento na hora de incorporar o medicamento ao SUS.
O que fazer?
Como assegurar que os orçamentos de sistemas de saúde do sul global não fiquem cada vez mais sobrecarregados com de novos medicamentos de alto custo do norte? Como enredar nos medicamentos também outras relações que permitam que os sistemas de saúde permaneçam viáveis? Como estabelecer um mercado farmacêutico global mais equitativo?
O licenciamento compulsório e a produção de genéricos, acumulam casos muito bem-sucedidos no passado, como os casos dos medicamentos antirretrovirais. No entanto tanto a conformação atual do mercado farmacêutico global, quanto as sanções impostas a quem viola acordos internacionais de patentes e a atual orientação política de diferentes países não parece apontar para esse caminho.
O ativismo contra as farmacêuticas será bem-sucedido em pressioná-las para a prática de preços justos de acordo com contextos diferentes? Seria possível que cada país estabelecesse seus próprios sistemas locais de produção de medicamentos, menos internacionalmente dependentes? Seria possível mesmo dadas as limitações do sistema de pesquisa e desenvolvimento nacional, como os cortes orçamentários citados no começo do post? Seria o caso de estabelecer uma regulação de mercados globais de medicamentos que seja um contrapeso às sanções feitas às quebras de patente? Seria isso possível em um mundo que vê os órgãos multilaterais cada vez mais enfraquecidos? Esse é um desafio ético, material, político, de justiça social que tem viajado dentro da caixa do medicamento.
Notas
[1] https://www1.folha.uol.com.br/educacao/2023/10/governo-lula-bloqueia-r-116-milhoes-do-orcamento-da-capes.shtml
[2] https://www1.folha.uol.com.br/equilibrioesaude/2023/10/governo-federal-gasta-r-575-mi-na-compra-de-tres-remedios-para-doencas-raras-por-ordens-judiciais.shtml
[3] O SUS é simultaneamente um motivo de orgulho para nós brasileiros, mas também de reclamações, em meio a permanentes tentativas de precarização e privatização.
[4] A opção por manter nesse texto a referência ao medicamento por seu nome comercial ‘Trikafta’ e não pela combinação de três nomes de moléculas elexacaftor/ivacaftor/tezacaftor, além de ser uma escrita mais prática e agradável (até como estratégia de marketing (Whyte 2002)), é para destacar justamente que se trata mais do que de compostos químicos, mas também de uma commodity que mobiliza todas múltiplas relações.
[5] Cabe destacar que a saúde ser um direito constitucional não é um problema em si, pelo contrário, é uma conquista derivada das mobilizações pela redemocratização do país nos anos 1980. O Estado deve prover o acesso aos medicamentos que são inacessíveis por um motivo ou outro. Vale salientar também que as demandas das pessoas com doenças raras e suas famílias são absolutamente legítimas e que, muitas vezes, trata-se das únicas alternativas terapêuticas disponíveis para garantir uma melhora na qualidade e na expectativa de vida.
Referências
Banerjee D (2017) Markets and Molecules: A Pharmaceutical Primer from the South, Medical Anthropology, 36:4, 363-380, DOI:10.1080/01459740.2016.1209499
Biehl J, Petryna A. Tratamentos jurídicos: os mercados terapêuticos e a judicialização do direito à saúde. História Ciênc Saúde-Manguinhos. 2016;23:173–92.
Marcus GE. Ethnography in/of the World System: The Emergence of Multi-Sited Ethnography. Annu Rev Anthropol. 1995; 24:95–117.
Whyte SR, van der Geest S, Hardon A. Social Lives of Medicines. Cambridge University Press; 2002. (Cambridge Studies in Medical Anthropology).
Zampoli M, Morrow BM and Paul G (2023) Real-world disparities and ethical considerations with access to CFTR modulator drugs: Mind the gap!. Front. Pharmacol. 14:1163391. doi: 10.3389/fphar.2023.1163391
